Спирты и фенолы
Спирты – органические вещества, содержащие одну или более гидроксильных групп (−OH), напрямую связанных с атомом углерода в состоянии sp3-гибридизации).
Фенолы – соединения ароматического ряда, в молекулах которых гидроксильные группы связаны с атомами углерода ароматического кольца.
Номенклатура и классификация
При использовании номенклатуры ИЮПАК названия спиртов характеризуются суффиксом -ол. В зависимости от числа гидроксильных групп спирты бывают одно-, двух-, трехатомные. В зависимости от того, при каком атоме углерода находится гидроксильная группа, спирты классифицируют на первичные, вторичные и третичные.
Строение и физические свойства
Строение спиртов отчасти схоже со строением воды. Как и в воде, между молекулами спирта образуются водородные связи, поэтому спирты имеют более высокие температуры плавления и кипения, чем можно было бы ожидать. Влияние гидроксильной группы на свойства вещества особенно велико в соединениях с короткой углеводородной цепочкой. Например, метанол и этанол неограниченно смешиваются с водой, имеют довольно высокие плотности и температуры кипения для своей молекулярной массы, а высшие спирты являются гидрофобными и мало отличаются по свойствам от аналогичных углеводородов без гидроксильной группы [9].
При рассмотрении фенолов необходимо выделить влияние гидроксильной группы –OH на ароматическое кольцо, которое повышает в бензольном кольце электронную плотность (особенно в орто- и пара-положениях) благодаря одной из неподелённых пар электронов кислорода, учавствующей в сопряжении с π-системой бензольного кольца. Смещение неподелённой электронной пары атома О в сторону бензольного кольца приводит к усилению полярности связи O–H. В итоге молекулы фенола распадаются в водных растворах с элиминированием протона, а значит фенол проявляет себя как слабая кислота. Это является основным отличием фенолов от спиртов, являющихся неэлектролитами. Основная часть одноатомных фенолов при нормальных условиях – бесцветные кристаллические вещества с низкой температурой плавления и специфическим запахом. Фенолы плохо растворяются в воде, но с легкостью – в органических растворителях. Они токсичны, а при хранении на воздухе постепенно окисляются и темнеют.
Химические свойства
Кислотно-основные реакции спиртов. Спирты способны проявлять как кислотные, так и основные свойства. Как кислоты, спирты с щелочными и щелочноземельными металлами, а также сильными основаниями (например, амидами или гидридами) реагируют с образованием алкоголятов:
2C2H5OH + 2Na → 2C2H5ONa + H2.
Спирты также проявляют основные свойства – образуют соли с сильными кислотами (соли алкоксония) и дают донорно-акцепторные комплексы с кислотами Льюиса:
R–OH + AlCl3 ⇄ R–OH+AlCl–3.
По связи О–Н → фенолы в большинстве реакциий активнее спиртов, так как эта связь полярнее из-за смещения электронной плотности от кислорода к бензольному кольцу (участие неподеленной электронной пары атома кислорода в системе π-сопряжения). Фенол с растворами щелочей дает соли – феноляты (например, фенолят калия – C6H5OК):
C6H5OH + NaOH = C6H5ONa + H2O.
Превращение спиртов в галогеналканы. Одной из наиболее важных реакций с участием связи C–O является превращение спиртов в галогеноалканы. Гидроксильная группа в спиртах может быть замещена на атом галогена:

Превращение спиртов в эфиры неорганических кислот. При действии концентрированной азотной кислоты могут быть получены органические нитраты:
C2H5OH + HNO3 → C2H5O–NO2 +H2O.
Превращение спиртов в простые эфиры. Медленно нагревая спирты в присутствии серной кислоты обеспечивается межмолекулярная дегидратация спиртов с образованием простых эфиров:
| 2ROH | 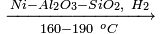 |
ROR + H2O. |
Превращение спиртов в сложные эфиры. Сложные эфиры получаются из спиртов в реакциях с органическими кислотами при нагревании с участием кислотного катализатора (чаще всего, концентрированной серной кислоты). Этот процесс имеет название кислотно-каталитической реакции этерификации:

Реакции окисления спиртов. Первичные спирты в зависимости от выбора агента окисляются до альдегидов или карбоновых кислот:
| CH2═CH–CH2OH |  |
CH2═CH–CHO. |
Вторичные – до соответствующих кетонов и кислот:
| R–CHOH–R´ | 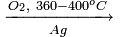 |
R–CO–R´. |
Третичные спирты устойчивы к окислению, однако под действием сильных окислителей могут быть расщеплены с разрывом углеродной цепи в различные карбонильные соединения.
Реакции восстановления спиртов. Неактивированные гидроксильные группы довольно устойчивы к гидрогенолизу и могут быть восстановлены в довольно жёстких условиях. Реакции гидрирования протекают при высоких температурах и давлении, в качестве катализаторов используются: никель, смешанные оксиды хрома-меди и т. д.
| RCH2OH + H2 |  |
RCH3 + H2O. |
Методы получения
Реакции окисления. Для получения первичных спиртов применяют окисление металлорганических соединений:
R–MgBr + CH2O + H2O → R–CH2OH + Mg(OH)Br.
При окислении алкенов происходит образование двухатомных спиртов:

Реакции восстановления. При мягком восстановлении карбонильных соединений: альдегидов, кетонов, карбоновых кислот и сложных эфиров также образуются спирты:
R–CHO + 2[H] → R–CH2OH;
R–COOR´ + 4[H] → R–CH2OH + R´OH.
Реакции присоединения – активно используется в промышленности при синтезе метанола:
CO + 2H2  CH3OH.
CH3OH.
Реакции замещения (гидролиза):
RCH2Cl + OH– → RCH2OH + Cl–,
CH3–Br + NaOH (водн.) CH3–OH + NaBr,
ClCH2–CH2Cl + 2NaOH (водн.) HOCH2–CH2OH + 2NaCl,
C6H5Cl + NaOH (p, 340°С) C6H5OH + NaCl.
Биохимические методы производства. Известный с давних времён способ получения этанола – спиртовое брожение органических продуктов, содержащих углеводы (виноград, плоды и т. п.) под действием ферментов дрожжей и бактерий. Схематично реакцию можно выразить уравнением [10]:
C6H12O6 → 2C2H5OH + 2CO2.
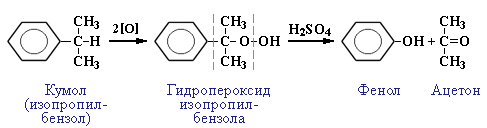
Кумольный способ получения фенола: (1949 г., Р. Ю. Удрис, П. Г. Сергеев, Б. Д. Кружалов). Получают сразу два продукта – куол и ацетон из кумола. Технология считается практически безотходной (выход полезных продуктов более 99 %) и экономичной. Сейчас кумольный способ используют как основной в мировом производстве фенола:
Применение
Одноатомные насыщенные спирты C3–C9, из которых главным компонентом является изоамиловый спирт, представляют основной компонент сивушного масла – побочного продукта спиртового брожения. Амиловый спирт используется для получения сложных эфиров, для целей парфюмерии и в производстве бездымного пороха. Пирокатехин и гидрохинон (парадигидроксибензол, бензол-1,4-диол) используют в фотографии как проявитель, в производстве красителей, лекарственных веществ. Фенол активно используется для производства фенолформальдегидных смол, поликарбона и эпоксидных смол, нейлона и капрона. Фенол и его производные также обуславливают консервирующие свойства коптильного дыма. Бутанол – компонент в топливных элементах и сырье для производства водорода. В 2007 г. в Великобритании начались продажи биобутанола в качестве добавки к бензину. Метанол используется для выпуска формальдегида, который используется для производства фенолформальдегидных смол и формалина, уксусной кислоты. Метанол используется для заправки гоночных мотоциклов и автомобилей. Этанол широко применяется как растворитель и антисептик: в пищевой промышленности; в качестве автомобильного топлива. Смесь этанола с бензином обозначается буквой Е. Цифрой и буквой Е обозначается процентное содержание этанола. Е85 – означает смесь из 85 % этанола и 15 % бензина. Биоэтанол как топливо нейтрален в качестве источника парниковых газов. Он обладает нулевым балансом диоксида углерода, поскольку при его производстве путём брожения и последующим сгоранием выделяется столько же CO2, сколько до этого было взято из атмосферы использованными для его производства растениями. Глицерин фармацевтическая и парфюмерная промышленность, смягчитель кожи и тканей, производство взрывчатых веществ.