Положения теории Бутлерова
Органическая и неорганическая химии не имеют строгой разграниченности. Принято считать, что органическая химия изучает структуры на основе углерода в четырехвалентном состоянии и водорода. Однако для того чтобы такое утверждение считать удовлетворительным, необходимо сделать целый ряд уточнений и дополнений.
Положения теории строения химических веществ А. М. Бутлерова заключаются в следующем:
1.Атомы соединены друг с другом в определенной последовательности в молекулах в соответствии с их валентностями. Химическим строением называется последовательность межатомных связей в молекуле. Она выражается конкретной структурной формулой.
2.Химическое строение может быть установлено химическими методами (в настоящее время используются также современные физические методы).
3.Свойства всех веществ диктуются их химическим строением.
4.Строение молекулы можно узнать по свойствам данного вещества так же, как и по строению, можно предвидеть свойства данного вещества.
5.Атомы и группы атомов (функциональные группы) в молекуле всегда оказывают взаимное влияние, что также отражается на их свойствах.
Теория Бутлерова является основой органической химии и послужила толчком к быстрому ее развитию. Основываясь на положениях теории, Бутлеров объяснил явление изомерии, предсказал существование изомеров и синтезировал некоторые из них.
В основе углеродного скелета лежит углерод с валентностью четыре, находящийся в одном из возможных гибридных состояний – sp-, sp2-, sp3-гибридизации. Рассматривая строение атома углерода и образованные им связи, мы опираемся на возбужденное состояние внешних электронных подуровней углерода:
| ↑ | ↑ | ↑ | ↑ | |
| 2s | 2p |
Как можно видеть, углерод находится в возбужденном состоянии и имеет четыре неспаренных электрона на внешнем энергетическом уровне. Возбужденное состояние при перескоке электрона с 2s- на 2p-электронный подуровень происходит достаточно легко, поэтому углерод чаще всего как в органических, так и в неорганических соединениях находится именно в этом состоянии.
Чтобы определить, в каком именно гибридизованном состоянии находится конкретный атом углерода в соединении, необходимо произвести анализ количества π- и σ-связей. При образовании четырех равноценных σ-связей между рассматриваемым атомом углерода и другими атомами молекулы в гибридизации участвуют все четыре электрона, образуются новые молекулярные орбитали – гибридные. Такой тип гибридизации называется sp3-гибридизация. При этом происходит усреднение как пространственных, так и энергетических характеристик 2s- и 2p-энергетического подуровней и отдельно взятых орбиталей в их составе (рис. 1).

Рис. 1. Sp3-гибридизация валентных орбиталей атома углерода
Тетраэдрическое расположение облаков, все углы между облаками – 109°28´.
В случае образования трех σ-связей и одной π-связи (присутствует одна двойная связь) не все валентные электроны участвуют в гибридизации. Для образования полноценной π-связи необходимо наличие p- или d-орбитали в неизмененном, симметрично вытянутом относительно узла между облаками, состоянии [1]. Происходит sp2-гибридизация. Выравнивание по энергии и форме происходит только между s-орбиталью и двумя p-орбиталями (рис. 2).

Рис. 2. Sp2-гибридизация валентных орбиталей атома углерода
Гибридизованные орбитали образуют плоский равносторонний треугольник. Углы между ними составляют 120°, негибридизованное облако располагается перпендикулярно этому треугольнику, проходя через его центр.
В случае образования двух π- и двух σ-связей (две двойные связи либо тройная и одинарная связи от одного атома углерода) происходит гибридизация только s-орбитали и одной р-орбитали. Оставшиеся две орбитали не претерпевают гибридизацию для обеспечения двух π-связей (рис. 3).
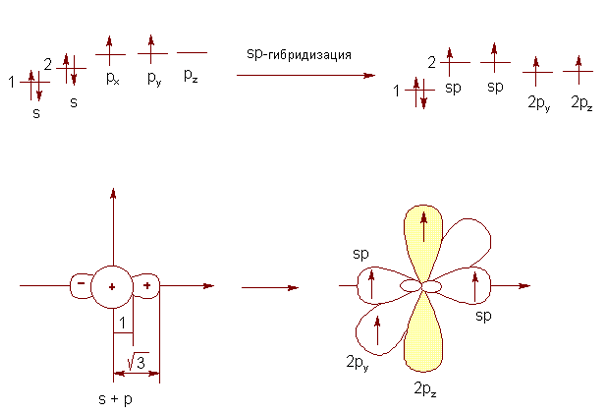
Рис. 3. Sp-гибридизация валентных орбиталей атома углерода
Гибридизованные облака располагаются под углом 180° друг к другу. Перпендикулярно им и друг другу располагаются две негибридизованных р-орбитали. Во всех трех случаях именно такое пространственное расположение соответствует минимальному отталкиванию между орбиталями, а также наиболее стабильному, уравновешенному состоянию. Важно отметить, что при образовании одинарной σ-связи возможно вращение вокруг нее, в то время как кратные за счет именно π-связи в их составе не позволяют осуществлять вращение (далее будет рассмотрен этот тип вращения, имеющий название – конформационное).
Классификация органических реакций
Органические реакции могут быть рассмотрены с точки зрения различных классификаций. Чаще всего – по конечному результату реакции или по механизму ее протекания.
Результат протекания реакции может быть выражен стехиометрическим уравнением, например: образование нового соединения из исходных, замещение фрагмента молекулы на иной фрагмент, перераспределение связей между атомами в молекуле и т. д. Таким образом различают:
- реакции присоединения (Ad);
- реакции замещения (S), например:
R–H + Cl–Cl = R–Cl + HCl,
Y– + R–X = R–Y + X–; - реакции элиминирования (Е);
- перегруппировки.
Механизм реакции – совокупность элементарных стадий, которые обеспечивают протекание рассматриваемой суммарной реакции. Все реакции состоят из элементарных актов. Простые – из одинаковых элементарных актов реакций и включают только одну стадию. Сложные реакции состоят из разных актов и представляют собой несколько элементарных стадий [2]. Элементарные реакции в зависимости по типу разрыва связей подразделяют на следующие виды. В гетеролитических реакциях разрыв связи будет происходить несимметрично, а пара электронов останется у одной из частей молекулы:
A : B = A: + B.
Так образуются карбокатионы и карбанионы.
Карбокатионы – частицы, заряженные положительно, которые содержат три заместителя из возможных четырех при центральном атоме углерода. Карбанионы – частицы, заряженные отрицательно, также с тремя заместителями при центральном атоме углерода, но уже имеющем орбиталь с парой электронов.
Гомолитические реакции – реакции, в которых разрыв связи так, что каждому из образующихся фрагментов отходит по одному электрону (сам процесс называется гомолизом):
A : B = A + B.
В результате протекания гомолитических реакций в роли интермедиатов выступают свободные радикалы – частицы, имеющие неспаренный электрон.
Синхронные реакции – это такой вид реакций, в которых за счет согласованного перемещения электронов разрыв старых и образование новых связей происходят одновременно. В органической химии вещества делятся на реагент и субстрат (реагент атакует субстрат). Субстрат – это такая молекула, которая дает атом углерода для новой связи. По типу реагента реакции можно выделить нуклеофильные (N), электрофильные (Е) и радикальные (R).
Нуклеофильная частица в химии (лат. Nucleus – «ядро», др.-греч. «любить») – реагент, образующий химическую связь с партнером по реакции путем донирования электронной пары. Нуклеофилы являются кислотами Льюиса, так как они являются донорами электронов. В роли нуклеофилов теоретически могут выступать все ионы и нейтральные молекулы с неподеленной электронной парой [3]. Нуклеофильная частица – это частица, в которой повышена электронная плотность и она способна взаимодействовать с электрон-дефицитными соединениями (электрофилами). Примерами нуклеофилов являются все анионы и соединения со свободной электронной парой (NH3, H2O). При реакции присоединения или замещения нуклеофильная частица приближается к месту на электрофиле, где сосредоточен положительный заряд.
В нуклеофильных превращениях нуклеофильная частица имеет на одном из атомов свободную пару электронов и является нейтральной молекулой либо анионом (Hal–, OH–, RO–, RS–, RCOO–, R–, CN–, H2O, ROH, NH3, RNH2 и др.). Нуклеофильная частица атакует в субстрате атом с низкой электронной плотностью (т. е. с положительным зарядом). Новая связь образуется за счет двух электронов нуклеофила, а старая гетеролитически разрывается. Примером нуклеофильной реакции может служить замещение (символ SN) у насыщенного атома углерода:
R–X (субстрат) + :Y– (нуклеофильная частица) = R–Y + :X
В электрофильных реакциях электрофил (атакующий реагент) является нейтральной молекулой или катионом (Cl2, BF3, H+, SO3, Br+, R+, NO2+, и др.) и имеет вакантную орбиталь. Все электрофилы являются основаниями Льюиса. Электрофил атакует в субстрате тот атом, у которого наибольшая электронная плотность, при этом старая связь разрывается в результате гетеролитического распада, а за счет пары электронов, принадлежащей субстрату, происходит образование новой связи.
В реакциях, которые называются радикальными, реагент имеет неспаренный электрон и является свободным радикалом. В результате реакций по радикальному механизму связь в субстрате рвется по гомолитическому механизму, новая образуется при помощи неспаренного электрона свободного радикала и одного из электронов старой связи. Пример радикальных реакций – замещение (символ SR) в предельных углеводородах:
R–H + Cl• = R• + HCl,
R• + Cl–Cl = R–Cl + Cl•.
Можно сказать, что лишь небольшое количество органических реакций протекает в одну стадию. Большинство являются сложными и состоят из нескольких последовательных или параллельных стадий. В зависимости от количества частиц, принимающих участие в превращениях, различают моно- и бимолекулярные реакции. Обычно классификации используют в сочетании друг с другом. В последовательных превращениях продукт одной элементарной реакции является исходным веществом для другой, например:
Суммарная реакция: А + С = D.
Стадия 1: А = В.
Стадия 2: В + С = D.
В результате подобных реакций образуются промежуточные соединения, которые называются интермедиаты и могут отражаться в итоговом уравнении. В указанной реакции подобным интермедиатом является В. Промежуточными продуктами в органических реакциях являются высокореакционноспособные частицы – свободные радикалы, карбокатионы, карбанионы. На рис. 4 указана энергетическая диаграмма реакции.
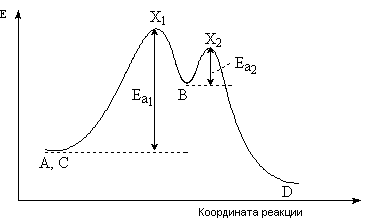
Рис. 4. Энергетическая диаграмма маршрута реакции с двумя интермедиатами
Энергетическая диаграмма имеет два максимума. Как раз оба максимума и соответствуют переходным состояниям Х1 и Х2. Интермедиат В получен через переходное состояние Х1, которое характеризуется достаточно высокой энергией активации Еа1. Промежуточное вещество В благодаря высокой реакционной способности и небольшой энергии активации Еа2 (переходное состояние Х2) далее претерпевает превращение в максимально стабильный конечный продукт D. Таким образом, стадия образования интермедиата определяет скорость процесса в целом и является лимитирующей [4].
Определение скорость-определяющей стадии имеет важное значение, так как все факторы, влияющие на эту стадию, влияют на скорость реакции в целом. Оценивая влияния различных факторов на скорость реакции, выявляют их влияние на энергии исходного и переходного состояний стадии, оказывающей лимитирующее влияние. Факторы, стабилизирующие переходное состояние, уменьшают энергию активации и увеличивают скорость реакции. Переходные состояния являются короткоживущими, их структуру не удается определить экспериментально, но ее можно оценить теоретически, сравнивая их с реальными частицами, близкими к ним по энергии. Это могут быть интермедиаты, которые рассматриваются как модели переходных состояний.
В параллельных (конкурирующих) реакциях из одних и тех же реагентов образуются разные продукты:
B ← А → C.
Энергетическая диаграмма такого процесса приведена на рис. 5.
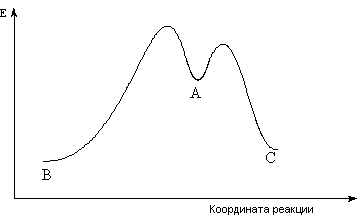
Рис. 5. Энергетическая диаграмма параллельных реакций
Состав продуктов конкурирующих реакций может зависеть от относительных скоростей их образования (кинетический контроль) или от их относительной термодинамической стабильности (термодинамический контроль).
Если обе конкурирующие реакции проходят необратимо, то состав продуктов может быть определен относительной скоростью их образования (кинетический контроль). Таким образом, в рассмотренной выше реакции будет преобладать продукт С, в соответствии с тем, что его образование происходит через переходное состояние с меньшей энергией.
Если одна или более из конкурирующих реакций является обратимой, то соотношение продуктов иное. Если остановить реакцию задолго до достижения равновесия, то реакция будет подчиняться кинетическому контролю и основным ее продуктом будет вещество С. Если процесс доведен до состояния равновесия, то в реакционной смеси преобладает более устойчивый термодинамически продукт В. Тогда реакция подчиняется термодинамическому контролю. На рис. 5 рассмотрен вариант несовпадения кинетического и термодинамического контроля продуктов реакции. Однако может наблюдаться ситуация, когда термодинамически устойчивый продукт образуется с большей скоростью, значит является кинетически и термодинамически контролируемым [5].
Электронные эффекты
Электронные эффекты – смещение электронной плотности в молекуле, ионе или радикале под влиянием заместителей.
Заместителями являются любые атомы (кроме водорода) или группы атомов, связанные с данным атомом углерода. Различают индуктивный (I) и мезомерный (M) эффекты заместителей.
Индуктивный эффект (I-эффект)
Полярная ковалентная связь – это связь между атомами с различной электроотрицательностью. Наличие в молекуле полярной s-связи содействует поляризации ближайших нескольких s-связей, что приводит к возникновению частичных положительных или отрицательных зарядов (δ+ или δ–) на соседних атомах. Смещение электронной плотности всех s-связей обозначается прямыми стрелками (по линии связи) и символами частичных зарядов, индуцируемых заместителем.
То есть заместители (X или Y) вызывают поляризацию и своей, и соседних связей. Этот вид передачи влияния атомов, приводящий к поляризации ковалентных связей и образованию зарядов на атомах, называется индукционным электронным эффектом. Индуктивный эффект – это смещение электронной плотности вдоль цепи s-связей, в результате различия в электроотрицательностях атомов [4, 5]. По причине слабой поляризуемости s-связей I-эффект быстро уменьшается при удалении от заместителя и через 3–4 связи практически исчезает. Индуктивный эффект является отрицательным (–I), когда заместитель уменьшает электронную плотность на углероде, с которым связан этот заместитель. В этом случае заместитель приобретает частичный отрицательный заряд (d-), а атом углерода приобретает частичный положительный заряд (δ+). Если заместитель увеличивает электронную плотность на атоме углерода, то индуктивный эффект называется положительным (+I), так как индуцируя на нем частичный отрицательный заряд δ-, сам он приобретает заряд δ+.
Атомом водорода, индуктивный эффект которого принят за 0, является ориентиром направления (знака) I-эффекта заместителя.
–I-эффект проявляют заместители, которые содержат более электроотрицательные атомы, чем атом углерода:
–OH, –F, –Cl, –Br, >C=O, –COOH, –NH2, –NO2 и др.
+I-эффектом обладают заместители, имеющие атомы с низкой электроотрицательностью:
–Li, –Mg–; алифатические углеводородные радикалы (–CH3, –C2H5) и т. п.
Мезомерный эффект (М-эффект)
Смещение электронной плотности по цепи делокализованных (сопряженных) p-связей называют мезомерным эффектом. Такой эффект соответствует заместителям, связанным с sp2- или sp-гибридизованными атомами. Из-за высокой подвижности p-электронов М-эффект без затухания передается по цепи сопряжения. +М-эффект имеет заместители, увеличивающие электронную плотность в сопряженных системах. Таковыми являются группы, содержащие атомы с неподеленной парой электронов, и способные передавать эту пару электронов в общую систему сопряжения. +М-эффект характерен для групп –OH и –NH2, например, в молекуле фенола C6H5OH группа –OH проявляет +М-эффект за счет участия одной из неподеленных электронных пар атома кислорода в системе сопряжения. –М-эффект характерен для заместителей с электроотрицательными атомами, которые смещают электронную плотность в свою сторону. –М-эффект характерен для групп –CH=O, –NO2, –COOH. Несмотря на то, что в этих группах есть неподеленные электронные пары, пространственное расположение их орбиталей с этими электронами не позволяет им участвовать в системе сопряжения. Получается, что заместитель может лишь оттягивать электроны из системы сопряжения из-за своей высокой электроотрицательности. Для определения знака М-эффекта строят атомно-орбитальные модели, показывающие пространственную ориентацию орбиталей, а также возможность их перекрывания.