Альдегиды и кетоны
Альдегиды – класс органических соединений, содержащих карбонильную группу (С=О) с одним алкильным или арильным заместителем.
Кетоны – это органические вещества, в молекулах которых карбонильная группа связана с двумя углеводородными радикалами.
Номенклатура и классификация
Систематические названия альдегидов строятся по названию соответствующего углеводорода с добавлением суффикса -аль. Общая формула альдегидов: R–CO–Н. Систематические названия кетонов строятся по названию соответствующего углеводорода и суффикса -он; нумерацию цепи начинают от конца цепи, ближайшего к карбонильной группе. Общая формула кетонов: R1–CO–R2. Среди других карбонильных соединений наличие в кетонах именно двух атомов углерода, непосредственно связанных с карбонильной группой, отличает их от карбоновых кислот и их производных, а также альдегидов.
Строение и физические свойства
Свойства альдегидов и кетонов диктуются особенностями строения карбонильной группы >C=O. В карбонильной группе атомы углерода имеют состояние sp2-гибридизации. При этом углерод sp2-гибридными орбиталями образует три σ-связи (одна из них с кислородом), располагающиеся в одной плоскости под углом около 120° по отношению друг к другу. π-связь образуется негибридизоваными р-электронами атомов углерода и кислорода [7].
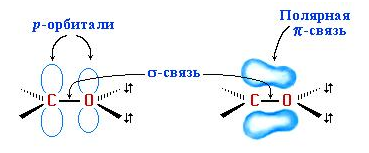
Связь С=О в сильной мере является полярной. Ее дипольный момент (2,6-2,8 D) намного выше, чем у спиртов – 0,70 D. Электроны кратной связи С=О, в особенности π-электроны, смещены к электроотрицательному атому кислорода. Это приводит к образованию частичного отрицательного заряда. Углерод карбонильной группы приобретает при этом частичный положительный заряд:
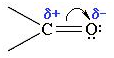
В молекулах альдегидов и кетонов нет атомов водорода, способных к водородной связи. По этой причине их температуре кипения ниже, чем у аналогичных спиртов. Метаналь (более распространенное название – формальдегид) – газ, альдегиды С2–C5 и кетоны С3–С4 – жидкости, последующие – кристаллические вещества. Растворимость низших гомологов достаточно высокая благодаря образованию водородных связей между атомами водорода молекул воды и карбонильными атомами кислорода. Чем длиннее углеводородный радикал, тем растворимость в воде ниже.
Химические свойства
Реакции присоединения по карбонильной группе. Присоединение большинства реагентов по двойной связи С=О происходит как нуклеофильное присоединение:

При взаимодействии кетонов с аммиаком образуются имины:

Реакции полимеризации. Полимеризация характерна в основном для альдегидов. К примеру, 40 %-ный водный раствор формальдегида (формалина) со временем дает параформ в виде белого осадка. Это полимер формальдегида с невысокой молекулярной массой:
H2C=O + H2O → (OCH2)n-2–O–CH2–OH (n=7, 8)
Реакции конденсации. Конденсация – это реакция, приводящая к возникновению новой углеродной связи и к усложнению углеродного скелета, при этом из двух более простых молекул образуется новая, более сложная. Обычно в результате реакции конденсации выделяется молекула воды или другого побочного низкомолекулярного продукта. Наиболее практическое значение имеет реакция фенола с формальдегидом в присутствии кислоты или основания:

Дальнейшее взаимодействие с другими молекулами формальдегида и фенола приводит к образованию фенолоформальдегидных смол.
Реакции восстановления альдегидов и кетонов. Альдегиды при взаимодействии с водородом в присутствии Ni-катализатора образуют первичные спирты, кетоны – вторичные:

Реакции окисления альдегидов и кетонов. Альдегиды очень легко окисляются в соответствующие карбоновые кислоты под действием даже таких мягких окислителей, как оксид серебра и гидроксид меди (II). Окисление происходит по связи С–Н в альдегидной группе –СН=О, которая превращается при этом в карбоксильную группу –С(OH)=O.
Реакция «серебряного зеркала» – окисление аммиачным раствором оксида серебра (реактив Толленса):
R–CH=O + 2[Ag(NH3)2]OH RCOOH + 2Ag↓ + 4NH3 + H2O.
Окисление гидроксидом меди (II):
1)в виде свежеприготовленного осадка Cu(OH)2 при нагревании;
2)в форме комплекса с аммиаком [Cu(NH3)4](OH)2;
3)в составе комплекса с солью винной кислоты (реактив Фелинга).
При этом образуется краснокирпичный осадок оксида меди (I) или металлическая медь (реакция «медного зеркала», более характерная для формальдегида):
R–CH=О + 2Cu(OH)2 → RCOOH + Cu2O↓ + H2О,
H2C=О + Cu(OH)2 → HCOOH + Cu↓ + H2О,
R–CH=O + 2[Cu(NH3)4](OH)2 → RCOOH + Cu2O↓ + 4NH3 + 2H2O,
R–CH=O + 2Cu(OH)2/соль винной кислоты → RCOOH + Cu2O↓ + 2H2O.
Кетоны не вступают в эти реакции.
Методы получения
Окисление спиртов. Из первичных спиртов при окислении образуются альдегиды, которые далее могут быть легко окислены до карбоновых кислот:

При окислении вторичных спиртов образуются кетоны:

Гидратация алкинов (реакция Кучерова). Присоединение воды к ацетилену в присутствии солей ртути (II) приводит к образованию ацетальдегида:

Кетоны получают при гидратации других гомологов ряда алкинов:

Кумольный способ получения ацетона (наряду с фенолом).
Применение
Ацетон – сырьё для синтеза многих важных химических продуктов, растворитель. Ацетон может вызывать значительное понижение уровня кислорода в воде из-за потребления его микроорганизмами. Бензальдегид – для синтеза красителей, душистых веществ, пищевой ароматизатор. Ванилин – ароматизатор. Диацетил (2,3-бутандион) применяется в пищевой промышленности при формировании запаха масла в производстве маргарина и других жировых пищевых продуктов. Хорошо маскирует синтетические добавки. Дифенилкетон (бензофенон) способен поглощать и отражать УФ-излучение, благодаря чему он может длительное время сохранять вещества от действия света. Поэтому его используют в качестве фотостабилизатора и фиксатора запаха и добавляют в отдушку для мыла, некоторые духи, косметику для защиты кожи от УФ-излучения, а также в некоторые красители и пигменты для защиты от УФ-излучения [5]. Акролеин является одним из продуктов термического разложения глицерина и жиров-глицеридов, чем объясняется раздражающие слизистые оболочки свойства дыма горелых жиров. Во время Первой мировой войны использовался в качестве химического оружия.