Алкины
Алкины также называют ненасыщенными углеводородами, так как присутствует одна тройная связь и характерны реакции присоединения.
Общая формула: CnH2n-2.
Гибридизация
Атомы углерода, участвующие в образовании тройной связи находятся в состоянии sp-гибридизации, остальные атомы углерода находятся в состоянии sp3-гибридизации.
Виды изомерии: изомерия цепи, изомерия положения тройной связи, межклассовая изомерия с алкадиенами.
Номенклатура
Название алкинов образуется из названия алкильного радикала с суффиксом -ин с указанием положения тройной связи.
Физические свойства
Физические свойства алкинов практически не отличаются от свойств соответствующих алканов и алкенов (С2–С4 – газы, С4–С16 – жидкости при нормальных условиях, далее – твердые вещества). Температуры кипения алкинов несколько выше, чем у соответствующих алкенов (несмотря на несколько меньшую молекулярную массу). Это также связано с большей полярностью связей, образованных sp-гибридизованными атомами углерода.
Химические свойства
По своим химическим свойствам алкины похожи на алкены. Для них также наиболее характерными являются реакции электрофильного присоединения. Для несимметричных алкинов, как и для алкенов, действует правило Марковникова. Существенным отличием является меньшая реакционная способность тройных связей по сравнению с двойными. Поскольку в результате присоединения обаразуется замещенный алкен (с более реакционно-способной связью), то при избытке присоединяющегося реагента реакция, как правило, идет дальше и образуется замещенный алкан:
 |
или |  |
| Алкин | Замещеный алкен | Замещеный алкан |
Гидрирование
В присутствии металлических катализаторов (Pt, Ni) алкины присоединяют водород с образованием алкенов (разрывается первая p-связь), а затем алканов (разрывается вторая p-связь):
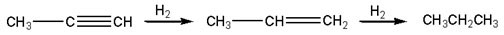 |
| Пропин | Пропен | Пропан |
При использовании менее активного катализатора гидрирование останавливается на стадии образования алкенов.
Галогенирование
Электрофильное присоединение галогенов к алкинам протекает медленнее, чем для алкенов (первая p-связь разрывается труднее, чем вторая). Алкины обесцвечивают бромную воду:
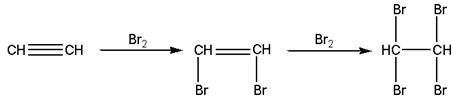 |
| Ацетилен | 1,2-Дибромэтилен | 1,1,2,2-Тетробромэтилен |
Гидрогалогенирование
Присоединение галогеноводородов также идет по электрофильному механизму. Продукты присоединения к несимметричным алкинам определяются правилом Марковникова [7]:
 |
| Пропин | 2-Бромпропен | 2,2-Дибромпропан |
Гидрохлорирование
Гидрохлорирование ацетилена используется в одном из промышленных способов получения винилхлорида. Винилхлорид является исходным веществом (мономером) в производстве поливинилхлорида (ПВХ).
Гидратация (реакция Кучерова)
Присоединение воды происходит в присутствии катализатора соли ртути (II) и идет через образование неустойчивого непредельного спирта, который изомеризуется в уксусный альдегид (в случае ацетилена) или в кетон (в случае других алкинов).
Полимеризация
1.Димеризация под действием водно-аммиачного раствора CuCl.
2.Тримеризация ацетилена над активированным углем приводит к образованию бензола (реакция Зелинского).
Возможно образование молекул, содержащих большее число звеньев ацетилена как циклического, так и линейного строения
… –СН=СН–СН=СН–СН=СН–…
(такие полимеры обладают полупроводниковыми свойствами).
Следует также отметить, что высокомолекулярное вещество – карбин (третья аллотропная модификация углерода) – образуется не в результате полимеризации ацетилена, а при окислительной поликонденсации ацетилена в присутствии CuCl.
Получение
Получение алкинов чаще всего производится по следующим реакциям:
 |
 |
| Карбид кальция | Ацетилен |
Алкины могут быть получены из соответствующих галогензамещенных алканов и алкенов.
 |
| 2,2-Дибромбутан | 2-Бромбутен-2 | Бутин-2 |
 |
| Бутен-1 | 1,2-Дибромбутан | Бутин-1 |
Применение
Ранее (а иногда и сейчас) ацетилен широко применялся для создания высокотемпературного пламени при газовой сварке. Сейчас на первый план вышло его применение для целей органического синтеза. Получение растворителей. При присоединении хлора к ацетилену получается тетрахлорэтан:
СН≡СН+2Сl2 = СНСl2–СНСl2,
а отщеплением от последнего молекулы хлороводорода – 1,1,2-трихлорэтен:
СНСl2–СНСl2 = СНСl=ССl2+НСl.
Алкадиены
Алкадиены также называют ненасыщенными углеводородами, так как присутствуют две двойных связи.
Общая формула:CnH2n-2.
Гибридизация
Атомы углерода, участвующие в образовании двойных связей находятся в состоянии sp2-гибридизации, остальные атомы углерода находятся в состоянии sp3-гибридизации.
Виды изомерии: изомерия цепи, изомерия положения двойных связей, межклассовая изомерия с циклоалкенами и алкинами. В зависимости от взаимного расположения двойных связей выделяют следующие алкадиены:
1.С изолированными двойными связями. Разделены в цепи двумя или более s-связями: СН2=СН–СН2–СН=СН2.
Такие двойные связи не оказывают друг на друга взаимного влияния, так как разделенны sp3-атомами углерода, и вступают в те же реакции, что и двойная связь в алкенах. Таким образом, алкадиены этого типа проявляют химические свойства, характерные для алкенов.
2.С кумулированными двойными связями, которые расположены у одного атома углерода: СН2=С=СН2 (аллен).
Подобные диены (аллены) относятся к довольно редкому типу соединений.
3.С сопряженными двойными связями, которые разделены одной s-связью: СН2=СН–СН=СН2.
Они отличаются характерными свойствами, обусловленными электронным строением молекул, а именно, непрерывной последовательностью 4-х sp2-атомов углерода.
Номенклатура
Название алкдиенов образуется из названия алкильного радикала с суффиксом -диен. После суффикса через запятую указывают наименьшие номера атомов углерода, участвующие в образовании двойных связей.
Физические свойства
Бутадиен – газообразное вещество (температура кипения – 4,5 °С), изопрен является жидкостью, кипящей при 34 °С, диметилбутадиен – также жидкость, кипящая при 70 °C. Изопрен и другие диеновые углеводороды полимеризуются в каучук. Натуральный каучук в очищенном состоянии – это полимер с общей формулой (С5Н8)n и получается из млечного сока некоторых тропических растений.
Химические свойства
Для алкадиенов, как и для других ненасыщенных углеводородов, наиболее характерны реакции присоединения с разрывом π-связи.
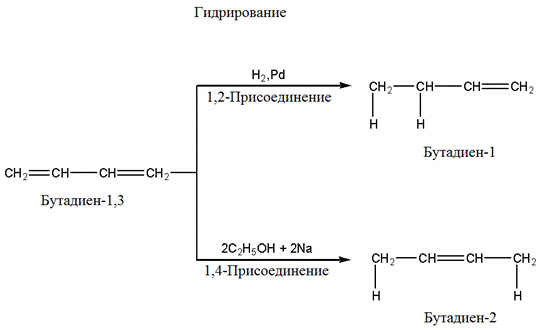

Так же как и для других углеводородов характерны реакции окисления.
Алкадиены хорошо подвергаются реакциям полимеризации. Важнейшими представителями для промышленно получаемых каучуков являются изопрен и бутадиен-1,3.
Применение
Широко используются в производстве синтетических каучуков и различных органических веществ отдельные представители этих диенов.